| Название продукта: |
Иодистая медь |
| Синонимы: |
Медный иодид (CuI); CuI; Гидро-giene; Marshite; Основа остаточных металлов иодида 99,999% меди (I); PuruM иодида меди (I), >=99.5%; 7440/05/3; Иодистая медь (иодид меди (I)) |
| CAS: |
7681-65-4 |
| MF: |
CuI |
| MW: |
190,45 |
| EINECS: |
231-674-6 |
| Категории продукта: |
галоид металла; Inorganics |
| Mol файла: |
7681-65-4.mol |
 |
| |
| Химические свойства иодистой меди |
| Точка плавления |
°C 605 (LIT.) |
| Температура кипения |
1290 °C/1 atm (decomp) (LIT.) |
| плотность |
5,62 g/mL на °C 25 (LIT.) |
| давление пара |
10 mm Hg (°C 656) |
| R.I. |
2,346 |
| Fp |
1290°C |
| temp хранения. |
Магазин под +30°C. |
| растворимость |
разбавьте водную кислоту: неразрешимый (LIT.) |
| форма |
Порошок |
| Удельный вес |
5,62 |
| цвет |
Белый побледнеть Браун |
| Растворимость воды |
НЕРАЗРЕШИМЫЙ |
| Кристаллическая структура |
Структура кубических, сфалерита - группа космоса f (- 4) 3m |
| Чувствительный |
Воздух & влага чувствительные |
| Merck |
14,2662 |
| Константа продукта растворимости (Ksp) |
pKsp: 11,9 |
| InChIKey |
LSXDOTMGLUJQCM-UHFFFAOYSA-M |
| Ссылка базы данных CAS |
7681-65-4 (ссылка базы данных CAS) |
| Ссылка химии NIST |
Иодид меди (I) (7681-65-4) |
| Система канцелярии вещества EPA |
Иодистая медь (7681-65-4) |
| |
| Информация о безопасности |
| |
| Использование и синтез иодистой меди |
| Медицинский осмотр и химические свойства |
Химическая формула CuI. Молекулярный вес 190,45. Белый кубический кристаллический или белый порошок, токсический. Относительная плотность 5,62, точка плавления °C 605, температура кипения конюшня 1290 °C., который нужно осветить и проветрить. Иодистая медь почти неразрешима в воде и этанол, soluble в жидкостном амиаке, разбавляет хлористо-водородную кислоту, иодид калия, цианид калия или решение thiosulfate натрия, может быть c разложенное oncentrated масляной серной кислотой и сконцентрированной азотноводородной кислотой.

Кислотное решение пентагидрата сульфата меди добавленный сверхнормальный иодид калия или под активностью, были добавлены, что dropwise к решению пентагидрата сульфата меди, получили смешанное решение иодида калия и thiosulfate натрия высыпание иодистой меди. В дополнение к общецелевой пользе как реагенты, etc., но также можно использовать как материал слоя сил-иодида термальный бумажный проводной, медицинская стерилизация, механический носить агент температуры, но также использовать для анализа ртути трассировки.
Токсичность: Увеличиваемый и повторяемый контакт с телом вреден, должен избежать непосредственного контакта с телом. Заглатывание больший вред к телу. |
| Реакция |
Медная примесь катализатора/основания полезная для экранировать реакции включая N-арилирование азот-содержа heterocycles. |
| Медистый галоид |
Иодистая медь и полухлористая медь, медистый бромид 3 общих медистых галоида, 3 белое твердое тело, photonasty иодистой меди хуже чем CuBr и CuCl, в светлой декомпозиции и высыпании йода. В природе, он существует в marshite. Полухлористая медь и медистый бромид могут быть произведены реакцией соответствуя кислотного решения divalent медного соли с медью. Иодистая медь была подготовлена путем добавление Cu2 + в решение иодида калия.
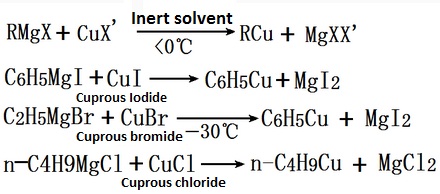
Иодистая медь и бромид или литий магния фенил в эфире могут произвести медный фенил.
Реакция метилового лития с ℃ иодистой меди at-15 или реакцией медного нитрата и tetramethyl руководства в ℃ этанола at-60 ~-40 может произвести метиловую медь.
Grignard реагент реагирует с медистым галоидом для произведения медистого hydrocarbyl, медистого галоида может быть иодистой медью, медистым бромидом, полухлористой медью.
Вышеуказанная информация отредактирована chemicalbook Yan Yanyong. |
| Обнаруживать mercuric тест иодистой медью |
Меркурий широко использован в различных типах промышленных аппаратур, зеркала, химиката и металлургии. Западное Lik спело, Saili разбросало, студенты музыки Gu Ren и другое органическое общее ртути использованы в земледелии как дезинфектанты и инсектициды семени. В фармацевтическом, подготовка Меркурия и польза хлорида ртути Mercuric, каломели, ртути и других преимуществ разведение использовано как обеззараживание, germicides, ртуть также могут сделать лекарство обработки как diuretics.
И смеси ртути токсические, как еда и халатная польза может причинить отравление.
[принцип] после того как сублимация ртути, тогда ее взаимодействует с медным иодидом, производя красный комплекс иодида ртути. Этот метод может быть обнаруженной ртутью 3μg.
Обнаруживать mercuric уравнение реакции иодида: 2Cu2I2 + HgHgCu2I4 + 2Cu
Иодистая медь хлопка [реагентов]: 5g пентагидрата сульфата меди, 3g безводного сернокислого железа, растворенное в 100mL воды, были добавлены решению иодида (7g иодида калия было растворено в воде 50mL) с активностью, центрифуговали приводя иодистую медь к высыпанию иодистой меди, после мыть, оно были пошевелены в пасмурную жидкость, гигроскопическую вату пропитанную с этим решением пасмурные сухие для запасной части.
Медь [деятельности] установленная в пробирках методом Leiyin Xi, хлопке иодида нежно покрывает spout. Дно трубки в топлении огня прямой наводки, если присутсвие ртути, хлопка поворачивает красной, то в то же время проводит пустой контроль.
Также попробуйте 1 падение пищеварительного сока, применяясь к иодистой меди хлопка, если настоящий момент ртути, хлопка поворачивает красный.
Ссылка: в Wiesen, высокий Ru Qin, редактор Jin Xiaomei, общие химические технологии избавления пищевого отравления быстрые. |
| Пользы |
1. Иодистая медь настолько широко использована как катализатор в органическом синтезе, модификаторе смолы, искусственных агентах осадок, крышке трубки катодного луча, так же, как источниках йода в подверганном действию йода соли. В присутствии к лиганду диамина 1,2 или 1,3, иодистая медь может катализировать реакцию арилового бромида, бромида винила и бромированной гетероциклической смеси преобразовывая к соответствуя иодиду. Реакция вообще в растворителе диоксана, и иодид натрия использован как реагенты иодида. Ароматичный генерал иодида более жив чем соответствуя хлорид и иодид, поэтому, иодид могут катализировать серию реакций, который включили в соединять галоидированный углерод, например, реакцию щеколд, реакцию Stille, реакцию Suzuki и реакцию Ullmann. В настоящем моменте дихлорированного палладиума bis (triphenylphosphine) (II), полухлористой меди и диэтиламина, 2 bromo-1-octen-3-ol с реакцией сочетания диссугаза 1-Nonyl произвести 7 sub-8-hexadecene-6-ol.
2. использованный как катализатор для органических реакций, заволакивания трубки катодного луча, также используемых как добавки корма для животных, иодид меди etc. и mercuric иодид может также быть использован совместно как индикатор измерять поднимающаяся температура механического подшипника.
3. по мере того как катализатор в много реакций, который включили в реагент Grignard, иодистая медь может также находиться в сухой реакции перераспределения Wiff. |
| Токсичность |
GRAS (FDA§184.1265, 2000). |
| Используя ограниченный |
0,01% (FDA§184.1265, 2000). |
| синтез |
Иодид меди (I) (CuI), может быть подготовлен путем нагревать йод и медь в сконцентрированной hydriodic кислоте, HI. Другой маршрут подготовки включает высыпание соли путем смешивать водные растворы иодида калия или натрия с пентагидратом сульфата меди или любым soluble солью меди (II): → CuSO4 + 2KI CuI2 + K2SO4. Неустойчивая смесь CuI2 немедленно разлагает в йод и sparingly soluble CuI, выпуская I2: 2CuI2 → 2 CuI + I2. CuI бедно soluble в воде (0,00042 g l−1 на 25°C), но оно растворяет в присутствии к NaI или KI для того чтобы дать линейное сложное − аниона [CuI2]. Разбавление таких решений с водой reprecipitates CuI. В много аспектов, медный иодид (I) может быть сосчитан как subvalent иодид меди (vide supra). |
| Способ производства |
Выведенный реакцией иодида пентагидрата сульфата меди и калия под слабо кислотными условиями. |
| Химические свойства |
Иодистая медь, Cu2O, кубические белые кристаллы, практически неразрешимые в H2O или алкоголе, soluble в NH4OH, иодиде калия, или цианиде калия. Использованный в реакции Sandmeyer для того чтобы синтезировать ариловые хлориды. |
| Химические свойства |
Иодид меди (I) естественно - происходящ как белизна к рыжеватокоричневому минеральному marshite. Он существенно неразрешим в воде но растворяет в complexing средствах массовой информации как амиак, цианид, и галоидные решения. Иодид меди (I) изготовлен pyrometallurgically реакцией горячей меди с паром йода в процессе существенно идентичном к этому для подготовки хлорида меди (I). Он также был произведен реакцией медного порошка с решениями метанола йода на температурах окружающей среды. Иодид меди (I) использован как добавка питания и как жара и светлый стабилизатор в некоторых полимерах и фотографических эмульсиях. Он также использован в засеве облаков и в индустрии бурения нефтяных скважин как адъювант anticorrosion. |
| Пользы |
Иодид меди (I) используемый в подготовке иминов alkynyl и синтезе пирролов и heterocycles пиррола. Он также использован в синтезе производных BTBT ([1] phene benzothio Benzothieno [3,2-b]) для пользы как полупроводники в транзисторах. |
| Пользы |
Катализатор для N-арилирования аминов и аминокислот |
| Пользы |
Как катализатор в органических реакциях; как химикат льда-nucleating; как покрывать в катоднолучевых трубках; как источник йода в кормах для животных; с HgI2 как индикатор tempereture; бактерицид. |
| Общее описание |
Непахучий загорите или -белое твердое тело. Раковины в воде. |
| Профиль реактивности |
Иодистая медь имеет слабые силы окислять или уменьшения. Реакции редоксов могут однако все еще произойти. Большинство смесей в этом классе немножко soluble или неразрешимо в воде. Если soluble в воде, тогда решения обычно ни сильно кислотны ни сильно основны. Эти смеси вод-не реактивны. |
| Опасность |
Токсический. |
| Опасность для здоровья |
Вдыхание причиняет раздражение носа и горла. Заглатывание медных солей производит жестокие тошнить и продувать, интенсивная боль, сброс давления, кому, конвульсии, и паралич. Контакт с глазами или раздражением причин кожи. |
| Опасность пожара |
Особенные опасности продуктов сгорания: Раздражая пары иодида или йода водопода могут сформировать в огне. |
| Методы очищения |
Оно может свежо быть подготовлено путем растворять соотвествующее количество CuI в кипеть насыщенный водный NaI над 30minutes. Чистое CuI получено путем охлаждать и разбавлять решение с водой, следовать путем фильтровать и мыть последовательно с H2O, EtOH, EtOAc, Et2O и пентаном, тогда сушить в - vacuo на 24 часа [Dieter, j до полудня Chem Soc 107 4679 1985]. Альтернативно помойте его с H2O, тогда EtOH и в конце концов с Et2O содержа меньший йод. Трассировки H2O наиболее хорошо извлекаются сперва путем нагревать на 110o и после этого на 400o. Exess I2 извлечется совершенно на 400o. Оно растворяет в Et2O если присутствуют, что формирует амин комплекс амина. На топлении будет красным, тогда черным, но изменением к белизне на охлаждать. Оно sparingly soluble в H2O или решения иодида алкалиа но охотно soluble в NH3 (который поглощает CO) и в решениях цианида или thiosulfate. [Glemser & Sauer в руководстве препаровочного VOL. II p 1007 1965 академической прессы неорганической химии (Ed Brauer), Bawn & Ledwith Chem Ind (Лондона) 1180 1957.] |
| |
| Продукты и сырье подготовки иодистой меди |
|
|