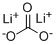| |
| Химические свойства углекислого лития |
| Точка плавления |
°C 720 |
| Температура кипения |
°C 1342 (LIT.) |
| плотность |
2,11 g/mL на °C 25 |
| Fp |
1310°C |
| temp хранения. |
Магазин на +5°C к +30°C. |
| растворимость |
13g/l |
| pka |
pKa 6,38 (неуверенное); 10,25 (неуверенный) |
| форма |
провод |
| цвет |
Белый |
| Удельный вес |
2,11 |
| ПЭ-АШ |
10-11 (5g/l, H2O, 20℃) |
| Растворимость воды |
13 G/L (ºC 20) |
| Merck |
14,5527 |
| Константа продукта растворимости (Ksp) |
pKsp: 1,6 |
| BRN |
3999191 |
| InChIKey |
XGZVUEUWXADBQD-UHFFFAOYSA-L |
| Ссылка базы данных CAS |
554-13-2 (ссылка базы данных CAS) |
| Ссылка химии NIST |
Углекислый литий (554-13-2) |
| Система канцелярии вещества EPA |
Углекислый литий (554-13-2) |
| |
| Информация о безопасности |
| |
| Использование и синтез углекислого лития |
| Описание |
Углекислый литий (молекулярная структура Li2CO3, английское имя углекислый литий) как бесцветный моноклинный кристаллический или белый порошок. Плотность 2,11. Точка плавления ℃ 618. Без плывучести, она стабилизирована в воздухе. Низкая растворимость в воде, растворимость уменьшает с увеличением температуры. Растворимость в холодной воде больше чем горячая вода. Она Soluble в разбавленной кислоте, неразрешимой в алкоголе и ацетоне. Углекислый газ введен в водную суспензию углекислого лития, углекислый литий преобразован к карбонату кислоты лития и растворен. Если решение карбоната кислоты лития нагрето и, то оно выпускает углекислый газ и осаждает углекислый литий. Природа углекислого лития может быть использована для того чтобы извлечь примеси из углекислого лития. В виду того что ион лития имеет сильную поляризуемость, таким образом термическая стабильность углекислого лития хуже чем другой карбонат щелочного металла, нагреванный к над точке плавления, оно разложит для произведения окиси углекислого газа и лития.
 |
| Химические свойства |
Углекислый литий белое моноклинное кристаллическое твердое тело. Типично для карбонатов, углекислый литий реагирует с кислотами более сильными чем углекислый газ или угольная кислота для того чтобы произвести соль лития кислоты и углекислого газа. Реакции могут быть унесены в решении, как водный slurry, или, более менее эффектно, с твердым углекислым литием.
Углекислый литий показывает растворимость отлива для карбоната щелочного металла. Растворимость уменьшает с увеличением температуры. Она не водоемка и вообще стабилизирована подверганный действию атмосферы. На самом деле, это нормальная смесь конца столкнулось когда много основных смесей лития подвергаются действию атмосферы. Углекислый литий может быть растворен в воде преобразованием к карбонату водопода. Выпускать углекислый газ путем нагревать решение карбоната водопода лития причиняет переосаждение углекислого лития. |
| Пользы |
Индустрия углекислого лития глобальная высокая индустрия монополии, емкость текущего производства главным образом сконцентрирована в 3 чужих изготовителях SQM, FMC, Chemetall и так далее.
Промышленный углекислый литий использован в изготовлении других солей лития, как хлористый литий и бромистый литий и так далее. Он также действует как материалы окиси лития в эмали эмали, стекла, гончарни и фарфора, и также добавлены, что к электролитическому элементу для электролиза алюминия увеличивает выход на токе и уменьшает внутреннее сопротивление клетки и температуры ванны. В медицине, оно главным образом использован для обработки мании, может улучшить их эмоциональные разлады для шизофрении. Оно имеет влияние повышать периферийные лейкоциты; смогите быть использовано для синтетической резины, красок, полупроводника и военной оборонной отрасли и так далее; для продукции tantalate лития, ниобата лития и других кристалла акустической ранга одиночного, оптически ранга monocrystalline etc; для подготовки кристалла акустической ранга одиночного.
Углекислый литий ранга батареи главным образом использован для подготовки окиси кобальта лития, окиси марганца лития, троичных материалов, фосфорнокислого железа лития и других материалов катода литий-ионного аккумулятора; использованный в модификаторе матрицы; как aneuroprotective влияние углекислого лития в боковом амиотрофическом склерозе. |
| Токсичность |
Углекислый литий имеет значительное возбуждающее влияние, во первых имеет повреждение на желудочно-кишечном тракте, почке и центральной нервной системе. Заказ токсичности смесей лития Li
носит резиновые перчатки и защитные маски при работе, для защиты дыхательных органов против пыли. |
| Подготовка |
Углекислый литий получен как промежуточный продукт во спасении металла от своей руды, spodumene лития (см. литий). Он подготовлен путем смешивать горячее и концентрированный раствор карбоната натрия с решением хлористого лития или сульфата.
Li2SO4+ Na2CO3→Li2CO3+ Na2SO4 |
| Реакции |
Углекислый литий реагирует с разбавленными кислотами, освобождая углекислый газ:
→LiCl HCl Li2CO3+ + CO2+ H2O
Термальные окись и углекислый газ лития выходов decompostion:
→ Li2CO3 Li2O + СО2
Реакция с известкой производит едкий литий:
Li2CO3+ Ca (OH) 2→2LiOH + CaCO3
Карбонат реагирует с жидким алюминиевым фторидом преобразовывая к фтористому литию:
→ 3Li2CO3+ 2AlF3 6LiF + 3CO2+ Al2O3
Оно совмещает с углекислым газом в водном slurry формируя soluble гидрокарбонат, который разлагает к карбонату на топлении:
Li2CO3+ CO2+ H2O →2LiHCO3
Гидрокарбонат нельзя отделить в твердой форме. Он существует только в решении когда карбонат растворяет в воде насыщенной с давлением CO2under. |
| Химические свойства |
Углекислый литий белый водоемкий порошок. |
| Физические свойства |
Белые моноклинные кристаллы; R.I. 1,428; плотность 2,11 g/cm3; плавит на 723°C; разлагает на 1,310°C; низкая растворимость в воде (1,54 g/100g) на 0°C; 1,32 g//100g на 20°C), уменшение растворимости с температурой (0.72g/100g на 100°C); неразрешимый в ацетоне и этаноле. |
| Пользы |
Самое общее лекарство лития углекислый литий, который обладает действием antimania. Предположено что литий изменяет переход ионов натрия в нейронах, таким образом влияющ на межмицеллярное содержание катехоламинов, нормализующ психическое состояние и не причиняющ общую летаргию. Оно использован для условий мании различных начал, предупредительных измерений, и для обрабатывать аффективные психозы. |
| Пользы |
Углекислый литий использован как смесь для произведения металлического лития. Углекислый литий результат обрабатывать минеральное spodumene с масляной серной кислотой и после этого добавлять углекислый кальций. Он использован как антидепрессант. |
| Пользы |
В продукции полив на керамическом и электрическом фарфоре. |
| Подготовка |
Углекислый литий подготовлен высыпанием иона лития ионом карбоната от водного раствора. Все еще другой процесс, который унесен в более небольшом масштабе, реакция решения едкого лития с газом углекислого газа. Углекислый литий осаждает и взят от решения супернатанта. |
| Определение |
углекислый литий: Белое твердое тело, Li2CO3; r.d. 2,11; m.p. 723°C; decomposesabove 1310°C. Оно producedcommercially путем обрабатывать руду с серной кислотой на 250°C andleaching продукт для того чтобы дать сульфат лития solutionof. Carbonateis после этого полученные решением карбоната натрия precipitationwith. Углекислый литий использован в обработке preventionand manicdepressivedisorders. Он также usedindustrially в керамических поливах. |
| Индикации |
Литий блокирует thyroidal внесение I в Tg, так же, как секретирование инкретей тиреоида, но он не блокирует работу symporter Na +-I- или накопление I внутри тиреоид. Литий не предлагает никакое определенное преимущество над лекарствами класса thionamide а может быть использован для временного контроля thyrotoxicosis в пациентах которые аллергически как к thionamides, так и к иодиду. |
| Фирменное наименование |
Eskalith (GlaxoSmithKline); Lithane (Bayer); Lithobid (JDS); Lithonate (фармацевтическая продукция Solvay). |
| Общее описание |
Lithiumcarbonate (Eskalith, Lithane) и цитрат лития (Cibalith-S) соли имеющиеся на рынке в theUnited государствах. |
| Профиль реактивности |
Основание. Разложенный кислотами с развитием углекислого газа. Ожога фтора яростно на контакте с углекислым литием. |
| Профиль безопасности |
Человеческие карциногенные данные. Отрава внутрибрюшинными и внутривенными маршрутами. В меру токсический заглатыванием и subcutaneous маршрутами. Человеческие внутрирастительные влияния заглатыванием: токсический психоз, треморы, изменения в жидком входе, слабость мышцы, увеличенный том мочи, тошнота или тошнить, аллергический дерматит. Человеческие воспроизводственные влияния заглатыванием: влияния на newborn, включая изменения Шкала Апгар и другие неонатальные измерения или влияния. Человеческие тератогенные влияния заглатыванием: отработочные ненормальности сердечно-сосудистой системы, центральных нервной системы, musculoskeletal и желудочно-кишечные тракты. Экспириментально teratogen. Экспириментально воспроизводственные влияния. Экспириментально карциноген производящ лейков и опухоли тиреоида. Человеческие данные по перегласовки сообщили. Использованный в обработке маниакальный-упадочных психозов. Несовместимый с фтором. См. также СМЕСИ ЛИТИЯ. |
| Химический синтез |
Углекислый литий синтезирован путем реагировать соли лития с содой или поташем, следовать очищением соли, которое нет охотно soluble [75]. 
|
| Потенциальная выдержка |
Углекислый литий использован в обработке маниакальный-упадочных психозов; сделать поливу керамики и фарфора; политуры, краски, фармацевтическая продукция, покрывать электродов для дуговой сварки; сплавы батареи; nucleonics, люминисцентные краски; стеклянная керамика; смазывая тавоты; в алюминиевой продукции |
| Доставка |
UN2811 токсические твердые тела, органические, n.o.s., класс опасности: 6,1; Ярлыки: материалы 6.1-Poisonous, техническое имя требовали |
| Методы очищения |
Выкристаллизовывайте его от воды. Свои уменшения растворимости по мере того как температура повышена. Растворимость в H2O 1,3% на ~10o, и 0,7% на ~100o. [D.nges в руководстве препаровочной неорганической химии (Ed. VOL. i p 987 1963 академической прессы Brauer), Caley & Elving Inorg Synth i 1 1939.] |
| Несовместимости |
Водный раствор сильное основание. Реагирует жестоко с кислотами, напудренным кальцием и фтором. Несовместимый с окислителями (хлоратами, нитратами, перекисями, перманганатами, перхлоратами, хлором, бромом, фтором, etc.); контакт может причинить огни или взрывы. Держите далеко от алкалических материалов, сильных кислот, напудренного кальция, фтора, влаги. Вытравливает алюминий, медь, цинк. |
| |
| Продукты и сырье подготовки углекислого лития |
|
|
|